|
由于表皮蜡质覆盖,大多数陆生植物的外观呈蜡质和白霜状,蜡的损失可能会导致光泽的表型,对于叶菜是个有利的性状。因此,鉴定表皮蜡质缺乏的植物并阐明控制表皮蜡质生物合成的调控机制将有利于农作物改良。河南省农业科学院园艺研究所&郑州大学农学院于《Theoretical and Applied Genetics》(5.699/Q1)发表文章《BrWAX2 plays an essential role in cuticular wax biosynthesis in Chinese cabbage (Brassica rapa L. ssp. pekinensis)》,将有助于更全面地了解植物角质层蜡代谢网络,并有助于加速培育具有鲜明绿色特征的油菜品种。 奥维森提供了转录组测序及分析服务。
研究背景覆盖在植物表面的角质层蜡在保护植物免受生物和非生物胁迫方面起着各种各样的作用。无蜡突变体茎叶表面具有光泽,在丰富大白菜种质资源、选育亮绿品种方面具有重要作用。然而,有关大白菜光泽性状的基因却鲜有报道。 研究方法植物材料: 亲本:蜡质双单倍体品系R16-11(P1)和光泽自交大白菜品系Y1211-1(P2) 子代:F1、F2、BC1P1和BC1P2(BC1P1和BC1P2分别由F1与R16-11和Y1211-1回交获得) 18种有光泽的芸苔材料(11种菜心和7种大白菜)和10种蜡质大白菜材料 方法: RNA-seq、BSA-seq、qRT-PCR
研究结果(1) Y1211-1的光泽性状是由单基因隐性基因控制 R16-11所有气生器官表面,如花序茎(图1a)、花序叶(图1b)、种子、花芽等均被蜡覆盖。相比之下,Y1211-1对应器官的外观(图1d、e)则趋向于光滑的绿色。用低温扫描电镜(Cryo-SEM)检测了花序叶片蜡晶密度,发现R16-11的叶片表面覆盖着大量蜡晶,主要为棒状和板状(图1c)。而Y1211-1的叶片仅被少量蜡晶覆盖(图1f),说明Y1211-1的光滑表型是由蜡晶减少引起的。
图1 两个亲本(R16-11和Y1211-1)表皮蜡质的表型特征
在F1群体中,所有个体都表现出蜡质表型,R16-11也是如此。F2和BC1P2群体存在表型分离现象。F2小群体蜡质和光泽个体数分别为148个和52个,分离比为3:1,F2大群体的分离比也为3:1。BC1P2种群中蜡质和有光泽个体数量分别为526和494,比例为1:1。200株BC1P1植株外观均呈蜡状。这些结果表明,Y1211-1的光泽表型是由一个单基因隐性基因控制的(表1)。我们将该位点命名为BrWAX2。
表1 R16-11与Y1211-1杂交后代光泽性状的遗传分析 (2)在有光泽的植物中,表皮蜡的产生会发生改变 为研究光泽的表型是否与蜡晶明显减少有关,通过GC-MS检查了W-bulk和G-bulk叶子的表皮蜡的含量和组成。与蜡质植物相比,光泽叶片上的总蜡量减少了46.6%。G-bulk中烷烃和醛的总含量分别下降了79.7%和95.3%。G-bulk中的醛类总含量大约是W-bulk中的2.86倍。C29烷烃(壬烷)和C30醛(三十烷),分别占W-bulk和G-bulk中总蜡量的约59.2%和55.6%。然而G-bulk中C29烷烃含量降低了83.7%,C30醛含量增加了约3.4倍。结果表明,Y1211-1中有光泽的表型是由于蜡含量减少,尤其是烷烃含量减少造成的。
图2 W-bulk和G-bulk叶片中的角质层蜡成分
(3)BrWAX2基因的精细定位 为了初步定位BrWAX2基因,对W-pool和G-pool进行BSA-Seq分析。在染色体A09上以95%的置信水平识别出一个从37.35到38.88 Mb的1.53 Mb候选区域。W-pool的平均SNP指数为0.60,而相应区域G-pool的平均SNP指数为0.11。结果表明,该基因组区间存在一个主基因,这与Y1211-1的光泽性状由一个隐性核基因控制的假设一致。 基于BSA-Seq分析,在候选区域建立了30个KASP标记,用于筛选两个亲本,12个KASP标记表现出良好的多态性。BrWAX2位点与LF2-K24和LF2-K17的遗传距离分别为0.5和0.1 cM,遗传图谱中标记的顺序与物理图谱中的顺序一致(图3a)。 使用flanking标记(LF2-K8和LF2-K30)筛选了967个有光泽的F2植物,并鉴定了90个重组体(图3b)。标记LF2-K30与BrWAX2基因共分离,所有90个重组体均被标记LF2-K8筛选出来,BrWAX2基因限定在标记LF2-K36和染色体A09末端之间的100.78 kb间隔。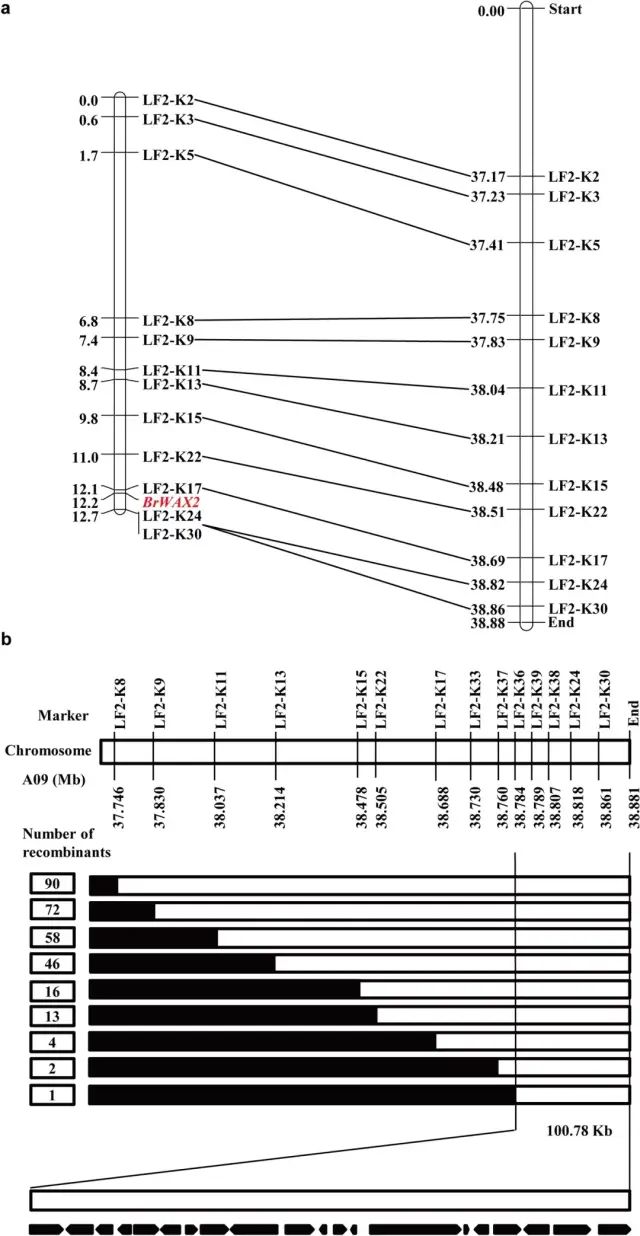 图3 大白菜BrWAX2基因的初步和精细定位
(4)候选基因分析 基于BrWAX2的精细定位结果,在Brassica数据库中分析了100.78kb间隔内的DNA序列,并对拟南芥进行了比较基因注释。结果显示,在作图区域识别出20个注释或预测基因(表2)。对来自BRAD的这20个基因的注释分析表明,只有一个名为Bra032670的基因可能是候选基因,该基因与拟南芥中的CER1同源。CER1编码一种醛脱羧酶,在角质层蜡生物合成过程中催化C30醛转化为C29烷烃。
表2 BrWAX2位点候选区间的注释基因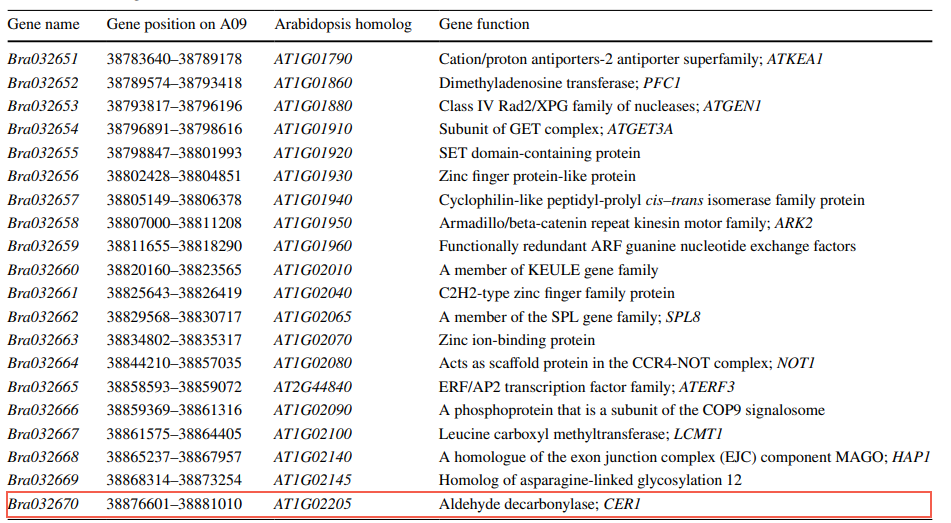
通过半定量RT-PCR和qRT-PCR来检测Bra032670在两个亲本不同组织中的表达情况。Bra032670在Y1211-1中的八种组织中均未转录(图4a)。相比之下,在R16-11中的茎、叶、萼片、花瓣、雄蕊和雌蕊表达要高得多。RNA-Seq分析显示Bra032670是差异最显著的基因,其在光滑茎中的表达水平约为蜡茎的13000倍(图4e)。结果表明Bra032670基因是BrWAX2最可能的候选基因。 为了鉴定候选基因在亲本系中的序列,使用引物BrWAX2-g1对Bra032670的基因组序列和编码序列进行扩增和测序。使用gDNA或cDNA作为模板从Y1211-1中没有获得扩增产物(图4b),推测在Y1211-1中缺少Bra032670基因。W-bulk中比对到Bra032670基因的BSA-Seq读数的数量为325,而G-bulk中只有56个(图4c)。Bra032670的平均BSA-Seq深度在W-bulk中为11.05,而在G-bulk中仅为1.70(图4d)。3个G-bulk重复中,Bra032670的RNA-Seq读数仅为1.01,相比之下,Bra032670在三个W-bulk的平均表达读计数高达13,532.12(图4e)。这些高通量测序数据进一步表明,Bra032670基因在Y1211-1中缺失。
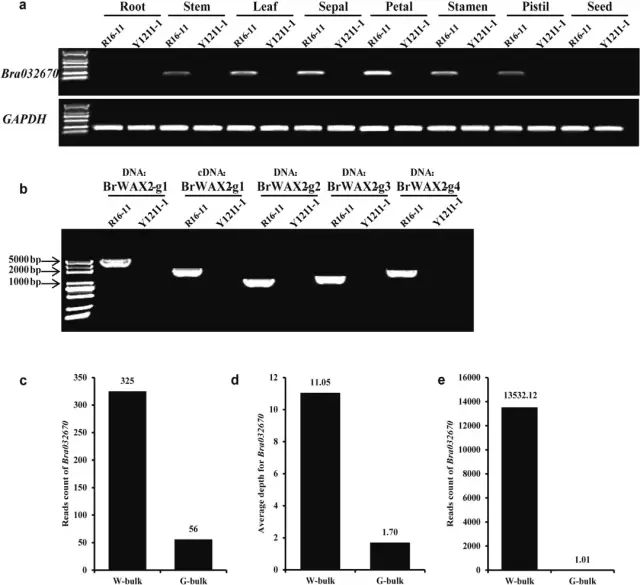
图4 BrWAX2候选基因分析 (5)蜡质和光泽茎的转录组分析 在W-bulk和G-bulk之间共检测到1399个DEGs。KEGG富集分析表明,角质、木栓质和蜡的生物合成、次生代谢物的生物合成和代谢途径是显著富集的途径(图5a),并且这些途径中的大多数基因在G-bulk中的表达水平较低,与光泽植物中蜡含量的降低一致。 与W-bulk相比,G-bulk中参与蜡生物合成的烷烃形成途径的基因如CER1(Bra032670)、CER3(Bra006802)和MAH1(Bra027906)显著下调,表明烷烃形成途径在G-bulk中受到抑制。参与角质层蜡转运的基因ABCG12(Bra031249)在G-bulk中上调。参与调节角质和蜡生物合成的基因WIN1(Bra026140)上调,而MYB96(Bra035893)和MYB96(Bra010085)在G-bulk中下调。此外,参与角质生物合成的基因,例如CYP77A6(Bra029852)、CYP86A4(Bra032642)和HTH(Bra003862),在G-bulk中显著上调(图5b)。进一步对蜡代谢相关基因进行qRT-PCR分析,与RNA-Seq结果一致(图6)。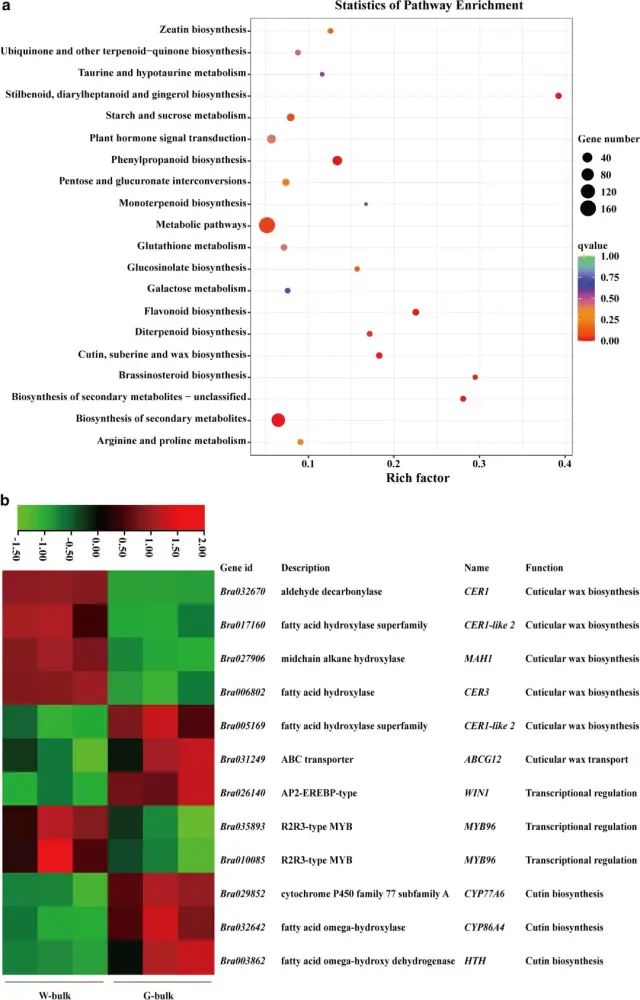 图5 蜡质和光滑茎的转录组分析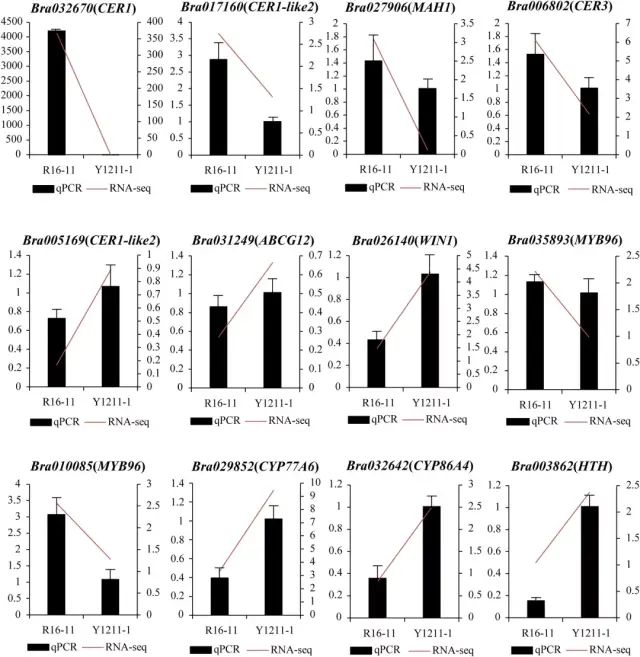 图6 用qRT-PCR验证RNA-Seq数据的表达 研究结论本研究确定了大白菜表皮蜡生物合成的BrWAX2基因。采用BSA-Seq和通过KASP分析的连锁分析将BrWAX2基因定位到100.78 kb的区间。RNA-seq功能注释分析、表达分析和序列变异分析表明,编码醛脱羧酶的Bra032670是BrWAX2最可能的候选基因。BrWAX2的缺失,以及烷烃形成途径中其他基因表达的降低,减少了蜡的数量,并导致了光泽表型。
转录组揭示大白菜表皮蜡质的生物合成基因 |